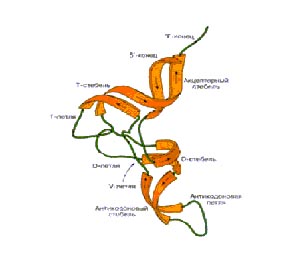
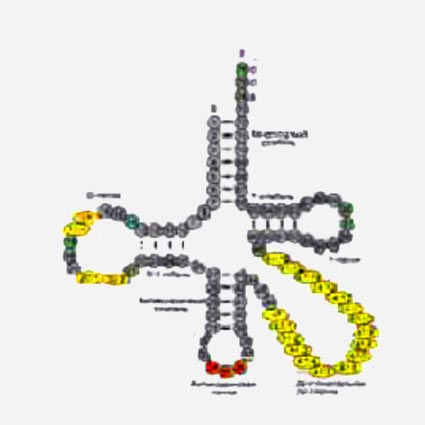
Рис. 2. Универсальная укладка полинуклеотидной цепи тРНК, названная клеверным листом. Каждому нуклеотиду присвоен свой номер, нумерация идет от 5' - к 3' - концу. Зелеными кружками показаны консервативные или полуконсервативные нуклеоиды.

Т-РНК
Основное назначение транспортной РНК (тРНК) - доставлять
активированные остатки аминокислот в рибосому
В 50-х
годах стало ясно, что информация для аминокислотной последовательности белков
закодирована в виде нуклеотидной последовательности матрицы. Хотя генетический
код еще не был раскрыт, Г. Гамов предложил считать, что он должен быть
триплетным. Между тем триплетный кодон не может узнавать боковые радикалы
аминокислот, поскольку между ними нет соответствия. Исходя из этого, Ф. Крик в
1955 году предположил, что должно существовать семейство малых молекул РНК. Не
прошло и двух лет, как гипотеза была доказана экспериментально: были открыты
тРНК и специфические ферменты, присоединяющие к ним аминокислотные остатки.
Впервые последовательность молекулы тРНК - дрожжевой аланиновой
тРНК - была расшифрована в 1965 году в лаборатории Р. Холли.
Все тРНК имеют общие черты как в структуре, так и в способе
складывания полинуклеотидной цепи во вторичную структуру. На рис. 1
представлены универсальные черты первичной и вторичной структур тРНК.
Особенности строения тРНК
органелл
Хлоропласты и митохондрии содержат автономно все компоненты,
необходимые для транскрипции и трансляции их генетической информации. ТРНК
кодируется геномом органелл.
ТРНК хлоропластов похожи на эубактериальные тРНК, что считается
следствием симбиотического происхождения хлоропластов. Все хлоропластные тРНК
укладываются в структуру клеверного листа и содержат консервативные и полуконсервативные
основания. Митохондриальные тРНК имеют палитру необычных структурных свойств.
У многих из них не обнаружено некоторых консервативных нуклеотидов. В митохондриальных
тРНК животных укорочены Т - и D-петли.
В каждой клетке присутствует более 20 видов тРНК. В кишечной
палочке 45 видов тРНК. Это значит, что несколько различных тРНК могут
соединяться с одной и той же аминокислотой; такие тРНК называются
изоакцепторными. Изоакцепторные тРНК могут узнавать кодоны для данной
аминокислоты. Если кодируется 4 или более кодонами, то обязательно существуют 2
или более изоакцепторных тРНК с разными антикодонами.
Для каждой из 20 аминокислот в клетках есть фермент, осуществляющий
синтез соответствующей аминоацил-тРНК (общее название -
аминоацил-тРНК-синтетаза). Все ферменты группы катализируют реакции
аминоацилирования тРНК. Реакция сопряжена с расщеплением
аденозин-5'-трифосфата (АТР) и протекает в две стадии. На первой стадии
происходит активация аминокислоты с использованием энергии, запасенной в АТР,
а на второй активированный аминоацильный остаток переносится на одну из
гидроксильных групп рибозного кольца концевого аденозина на ССА-конце тРНК.
Например, валил-тРНК-синтетаза катализирует реакцию синтеза
валил-тРНК:
Vа1 +
тРНК. + АТР = Vа1-тРНК + АМР + РР, (1)
включающую две стадии.
Е + Vа1 + АТР =
Е*(Vа1-АМР) + РР, (2)
Е*(Vа1-АМР) + тРНК = Е + АМР + Vа1-тРНК, (3)
где Е — фермент, Vа1-
валин, АТР и АМР — аденозин-5'-три - и монофосфат соответственно, РР
-пирофосфат, Е*(Уа1-АМР) — комплекс фермента с аминоациладенилатом, тРНК -
специфическая валиновая тРНК. Vа1-тРНК - валил-тРНК.
Как видно из уравнения (2) на первой стадии аминоациладенилат Vаl-АМР, в
котором остаток валина активирован за счет гидролиза макроэргической связи АТР
и отщепления пирофосфата, не покидает молекулы валил-тРНК-синтетазы, образуя с ней комплекс.
Происходящий затем перенос аминоаллильного остатка из Vа1-АМР на валиновую тРНК
завершает реакцию аминоацилирования тРНК и приводит к освобождению фермента и
АИР
Молекулярные основы
узнавания тРНК аминоацил-тРНК-синтетазами
Каждая тРНК, сохраняя L-образную
форму, должна иметь отличительные признаки, распознаваемые "своим"
ферментом. На сегодняшний день ученые знают набор нуклеотидов, которые
занимают одни и те же положения в структуре большинства тРНК. Это следующие
участки тРНК:
1. Антикодон. Участие антикодона, определяющего на рибосоме
включение аминокислоты в цепь белка и
в отборе этой аминокислоты на стадии реакции аминоацилиравания тРНК.
2. Первые три пары нуклеотидов акцепторного стебля (1-72, 2-71,
3-70). Синтетазой может вовлекаться от одной до трех пар нуклеотидов
акцепторного стебля.
Экспериментальные данные свидетельствуют, что тРНК узнаются
аминоацил-тРНК-синтетазами из других организмов. В случае некоторых тРНК к
элементам узнавания относят неконсервативные нуклеотиды D- и
Т-петель (в первую очередь 20 D –петли). У каждой тРНК-синтетазами может узнаваться только
часть перечисленных элементов.
Молекулы тРНК - пионеры нуклеиновых кислот. Дрожжевая аланиновая
тРНК стала первой расшифрованной нуклеиновой кислотой. ТРНК оказались первыми
природными полирибонуклеотидами, которые удалось закристаллизовать и изучить
методом рентгеноструктурного анализа. ТРНК ответственны за начало синтеза
белковой молекулы, за ее удлинение и завершение.
Список литературы
Киселев Л.Л., Лаврик О.И.
«Биосинтез белков от аминокислот до аминоацил – тРНК», М.: «Наука», 1984
Спирин А.С., «Молекулярная
биология: Структура рибосомы и биосинтеза белка». М.: Высш.шк., 1986.


Рис. 2. Универсальная укладка полинуклеотидной цепи тРНК, названная клеверным листом. Каждому нуклеотиду присвоен свой номер, нумерация идет от 5' - к 3' - концу. Зелеными кружками показаны консервативные или полуконсервативные нуклеоиды.
